 |
Johanneum zur EXPO 2000 | ||
| Die Natur als Erfindung des Menschen | |||
| Naturwissenschaft Stationen Arbeitsblätter |
|
3 |
Theorie |
P |
|
Reaktionen an den Elektroden |
(Benutze einen Extrazettel für deine Antworten)

1. Erläutere nun denVorgang, wiean der Anode aus den Chlorid-Ionen neutrale Chloratome werden, die du als Chlorgas wahrgenommen hast.
2. Verdeutliche die Zusammenhänge, indem du die Chlorid-Ionen, Chloratome, (möglichst in anderer Farbe ) und Elektronen (eŽ ) in die Abbildung unten einzeichnest und mit Pfeilen die Bewegungsrichtungen markierst. Die dazugehörige Reaktionsgleichung (Chlorid-Ionen reagieren zu Chlor und
und Elektronen eŽ) kannst du unter die Anode schreiben (Simbole!).
3. Beschreibe dieVorgänge an der Kathode und zeichne sie in die Kathode ein. Schreibe darunter die Reaktionsgleichung an der Kathode.
4.Gesamtgleichung: du hast Oben schon einmal die Reaktionsgleichung dieser Elektrolyse notiert. Nachdem du jetzt viel dazu gelernt hast, kannst du eine mit derIonenschreibweise verbesserte Reaktionsgleichung aufstellen. Vergiss dabei nicht die Ladungen, die Aggregatzustände und den Energieumsatz! Bei der Gesamtgleichung können die Elektronen weggelassen werden, da sie ja während der Reaktion abgegeben und aufgenommen werden, also weder bei den Eduktennoch bei den Produketen freie Elektronen vorkommen.5. Geschlossener Stromkreis (Extrazettel)
Beachte, dass ein von der Kathode abgegebenes Elektron niemals zur Anode gelangt, da es in der entstandenen Kupferportion bleibt. Versuche trotzdem geschlossenen Stromkreislauf zu erklären ! Bleibt der Stromkreis endlos geschlossenen, oder wird er irgendwann unterbrochen ?

Elektrolyse einer Kupferchlorid-Lösung:
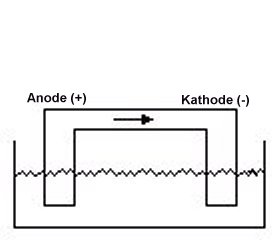
Reaktionsgleichungen:
Anode:
Kathode:
Gesamgleichung:
![]()
![]() Autorin: Birte Bottler (Stud Ref'.) Web:
Dominic Blechert (Abi 2006), Philipp Hippe (Abi 2005)
Autorin: Birte Bottler (Stud Ref'.) Web:
Dominic Blechert (Abi 2006), Philipp Hippe (Abi 2005)
 [Naturwissenschaft] [Station] [Arbeitsblätter]
[Naturwissenschaft] [Station] [Arbeitsblätter] ![]() [Dokuteam] [Email s.Ueberblick]] [Physik] [Chemie]
[Dokuteam] [Email s.Ueberblick]] [Physik] [Chemie] 