|
Experimentelle Ergebnisse
|
Erläuterung
|
Atommodell
|
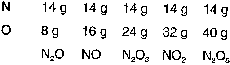
|
Die Bobachtung der ganzzahligen Massenverhältnisse von Stickstoff und Sauerstoff in Verbindungen führte Dalton zu der Vorstellung, es müsse "Einheitspakete" geben, die Atome. |
|
|
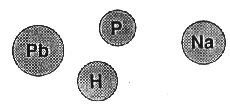
Die Beobachtung der Elektrolyse,der Ablenkung in der - heute so genannten -
Kathodenstrahlröhre und der Radioaktivität führten J.J. Thomson
zu der Annahme, es müsse elektrisch geladene Teilchen im Atom geben, von denen die negativ geladenen die leichteren seien.
|
|
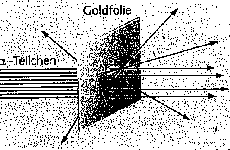
|
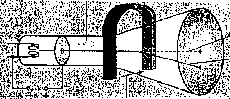
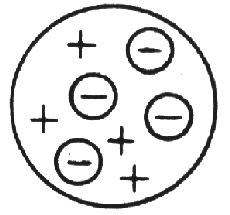
Bestrahlte man eine ganz dünne Goldfolie mit Alphateilchen (Heliumkernen), so kamen die allermeisten ohne Ablenkung hindurch. Ein kleiner Teil von ihnen jedoch wurde mehr oder weniger heftig gestreut. Das führte Rutherford zu dem Modell eines kleinen aber sehr schweren positiv geladenen Atomkerns und einer großen dünn besetzten Hülle von negativ geladenen Elektronen.
|
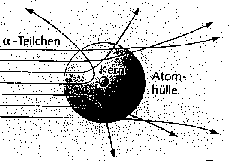
|

Linienspektrum bei der Spektralanalyse
|
Jedes leuchtende chemische Element sendet Licht nur ganz bestimmter Wellenlängen aus, hat also sein charakterischtisches Linienspektrum. Bei der Spektralanalyse werden die Elemente daran erkannt. Um diese Beobachtung zu deuten, dachten sich Bohr und Sommerfeld die Elektronen wie Planeten auf Bahnen um den Atomkern kreisend. Dieses bohrsche Atommodell ist sehr populär geworden und steht - wie auch im neuen Logo unserer Schule - als Ikone für das Atom überhaupt. |
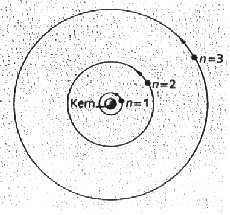
|
Zum Berechnen von Bahnen (Orbits) gehören immer Ort und Geschwindigkeit.
Heisenberg erkannte, dass sich für ein Elektron niemals beide Größen mit beliebiger Genauigkeit bestimmen lassen. Es gilt die heisenbergsche Unschärferelation.
Heute stellt man sich vor, ein Elektron befinde sich mit einer gewissen Aufenthaltswahrscheinlichkeit an einer Stelle seines Orbitals. Neuere Untersuchungen zeigen, dass die Orbitale jeweils speziell geformte Bereiche um den Atomkern sein könnten. |
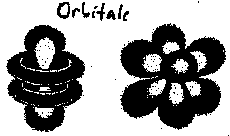
|
| Vermutlich ist auch dieses nicht das letzte Atommodell. Daher ist es auch nicht das "wahre" Modell.
Eine gemeinsame Theorie von Quantenmechanik und Gravitation wünschen sich viele Physiker. Sie ist bisher aber noch nicht gefunden.
In diesern Bereichen der Physik (mindestens) ist Wissen ohne Modellvorstellung und Theoriebildung nicht vorstellbar.
|

![]()
![]()
![]() Autor: Dr. Andreas Palmer, Abitur 82
Web: [Dr. Dörte Haftendorn] Datum: 29. Mai 99. Letzte Änderung am
Autor: Dr. Andreas Palmer, Abitur 82
Web: [Dr. Dörte Haftendorn] Datum: 29. Mai 99. Letzte Änderung am  [Naturwissenschaften] [Kristallphysik]
[Naturwissenschaften] [Kristallphysik] ![]() [Dokumentationsteam] [Email s.Ueberblick] [Physik]
[Dokumentationsteam] [Email s.Ueberblick] [Physik] 